La recherche clinique concerne l’être humain. Elle a pour objectifs d’améliorer la connaissance de la maladie, améliorer la qualité de vie, trouver de nouvelles méthodes d’exploration et quantification de la maladie ou de traitements, et développer des thérapies.
Il existe des études et des essais cliniques comme présenté dans le tableau ci-dessous (traduit de FARA : Clinical Trials 101 : A Guide For Participants)
ETUDES CLINIQUES
C’est une étude d’observation.
- Objectifs : décrire/mesurer/observer la maladie.
- Aucune intervention n’est testée (aucun médicament, aucun traitement, aucun dispositif).
- Exemples : études de biomarqueurs, études d’histoire naturelle, d’imagerie, etc.
- Le consentement éclairé s’applique dans certains cas.
ESSAIS CLINIQUES
C’est une intervention.
- Objectifs : tester un médicament, un traitement, un dispositif.
- En général, un patient ne peut pas participer à plus d’un essai clinique à la fois.
- Le consentement libre, éclairé et écrit s’applique.
Les études cliniques
Le consortium européen Effacts
Regroupant chercheurs fondamentaux et cliniciens, spécialistes de l’ataxie de Friedreich, EFACTS (European Friedreich Ataxia Consortium for Translational Studies) a été créé en 2010. Le Consortium EFACTS est un réseau de structures hospitalières et de recherche (16 en octobre 2022) couvrant plusieurs pays européens (10 en octobre 2022) pour collecter des données longitudinales (= sur la durée) sur l’histoire naturelle d’une grande cohorte de patients génétiquement définis comme atteints d’ataxie de Friedreich. A la direction du consortium, l’hôpital universitaire d’Aix-la-Chapelle (Pr Jörg Schulz) qui a succédé au Prof. Massimo PANDOLFO.
Les objectifs sont les suivants :
- Mieux comprendre l’histoire naturelle de l’Ataxie de Friedreich, c’est-à-dire mieux comprendre tous les aspects de la maladie avec sa complexité
- Etudier la structure et la fonction de la frataxine
- Etudier la pathogénicité dans la maladie
- Etudier les mécanismes de répression du gène de la frataxine
- Créer de nouveaux modèles cellulaires et animaux pour l’étude de la maladie
- Découvrir des biomarqueurs (très importants pour les essais cliniques)
- Identifier les modificateurs génétiques de la maladie
- Développer de nouvelles approches thérapeutiques.
La banque de prélèvements biologiques (bio-repository) et le registre d’histoire naturelle (1.103 patients en octobre 2022 et 67 sujets contrôle sains), accessibles à la communauté scientifique, permettent les études sur l’histoire naturelle de la maladie (symptômes, développement, évolution…) ainsi que le recrutement de patients pour les essais cliniques. Les premiers patients enrôlés sont suivis depuis plus de 10 ans.Des liens de plus en plus forts ayant été établis avec FARA aux Etats-Unis, une puissante association US de soutien à la recherche pour l’ataxie de Friedreich, des négociations ont été menées depuis plusieurs années qui ont abouti en 2022 à la signature d’une convention pour organiser le partage des données européennes et américaines. Cette convention institutionnalise la constitution d’une plate-forme neutre et indépendante de collaboration et d’analyse de données pour promouvoir le partage de données essentielles sur l’ataxie de Friedreich, selon un référentiel de procédures commun à toutes les structures parties prenantes.
Documents associés
Fonctionnement des essais cliniques
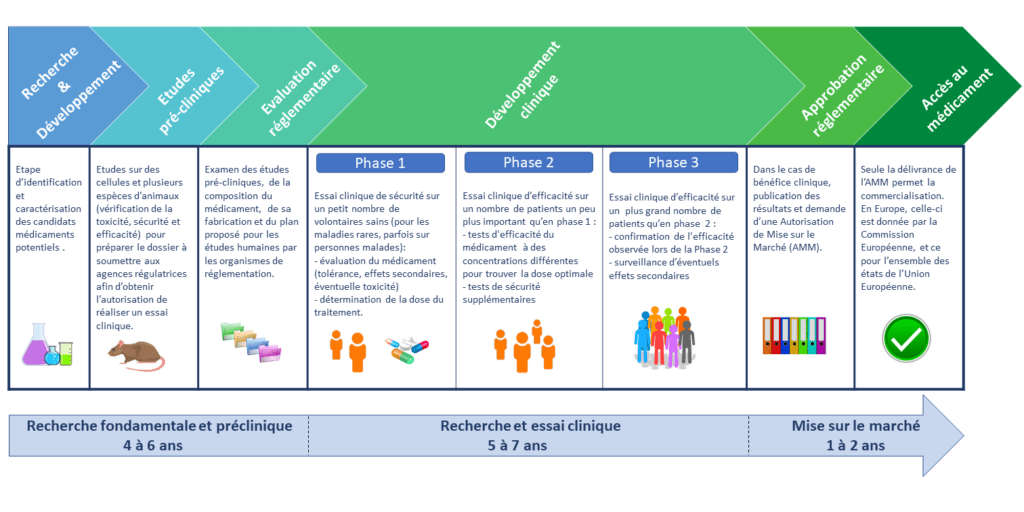
Les étapes d'un essai clinique
Etudes précliniques : le candidat médicament est testé sur des cellules et des animaux (non BPL). Le promoteur doit tester le nouveau candidat médicament sur des animaux pour vérifier la toxicité (BPL). Plusieurs espèces sont utilisées pour recueillir des informations sur la sécurité et l’efficacité du composé. Ces études servent à préparer le dossier à soumettre aux agences régulatrices afin d’obtenir l’autorisation pour réaliser un essai clinique.
Evaluation réglementaire : les organismes de réglementation examinent les études pré-cliniques, la composition du médicament, sa fabrication et le plan proposé pour les études humaines. Pour réaliser un essai clinique aux USA, le promoteur doit soumettre une “IND” (Investigational New Drug Application, équivalent à la demande d’autorisation d’essai clinique auprès de l’ANSM). La FDA (Food and Drug Administration) examine la demande pour s’assurer que les études proposées, n’exposent pas les sujets humains à un risque déraisonnable de préjudice. La FDA vérifie également le consentement éclairé et la protection des sujets humains. En France, c’est le rôle des CPP (Comités de Protection des Personnes) et de l’ANSM (Agence Nationale de Sécurité du Médicament et des produits de santé). Essai clinique de sécurité chez l’homme. Il sert à évaluer si le médicament est sûr et s’il y a des effets secondaires indésirables.
Développement clinique : il se déroule en plusieurs phases.
Approbation réglementaire : s’il y a un bénéfice clinique, les développeurs demandent une autorisation de mise sur le marché (AMM). Le dossier regroupe les données des essais précliniques, cliniques, sur la qualité chimique ou microbiologique du produit fini et les procédés de fabrication de la substance active et du produit fini. Le dossier d’AMM aura le même contenu quelle que soit la procédure engagée : pour l’EMA (Europe) ou pour la FDA (NDA: New Drug Application). Dans le cas des maladies neurodégénératives et maladies rares, une procédure au niveau européen “centralisée” est obligatoire.
Accès au médicament : pour l’Europe, l’EMA formule une recommandation à l’intention de la Commission Européenne, qui prend ensuite une décision finale sur l’AMM sur le marché du médicament dans l’UE. L’AMM est donc délivrée par la Commission Européenne et est valable pour l’ensemble des Etats membres. L’AMM constitue un préalable obligatoire à toute possibilité de commercialisation d’une spécialité pharmaceutique. En France, elle est également indispensable avant la demande d’inscription au remboursement par l’Assurance Maladie.
Essais cliniques de Phase 4 : après l’approbation d’un médicament par les autorités de réglementation, il peut rester des questions sans réponse sur l’efficacité ou le profil de sécurité du médicament. Par conséquent, des études de Ph4 peuvent être menées pour répondre à ces questions, même après qu’un médicament a été approuvé par un organisme de réglementation et est disponible sur ordonnance.
Participer à un essai ou une étude clinique
Participer à un essai clinique
Un essai clinique sur un médicament consiste à étudier, selon un protocole précis, les effets d’une molécule chez l’homme, qu’il s’agisse de volontaires malades ou sains. Le but des essais est d’établir la sécurité d’emploi et l’efficacité d’une substance.
Les essais cliniques sont encadrés par des lois et doivent obéir aux règles de bonnes pratiques cliniques.
La participation à un essai est une démarche individuelle, volontaire et qui demande un engagement éclairé. Un essai clinique se fait sous la conduite d’équipes de médecins (appelés investigateurs), compétentes et expérimentées, qui connaissent avec précision la maladie, les traitements existants et les conditions requises pour participer à l’essai.
Le médecin doit vous expliquer l’essai auquel il vous propose de participer. Seul l’investigateur de l’essai clinique décide ou non d’accepter une candidature.
Documents associés
Principaux essais et études cliniques en cours
Les essais en cours
Les essais en cours de recrutement
- Etude visant à évaluer le Nomlabofusp chez les adolescents et les enfants AF – Promoteur : Larimar Therapeutics
- Identifiant ClinicalTrials.gov : NCT06681766
- Notre compréhension du principe : Thérapie de remplacement de la frataxine, en utilisant le couplage de la frataxine à une protéine transporteuse.
- Objectif : Évaluer la sécurité et la tolérabilité du nomlabofusp (CTI-1601) chez les adolescents et les enfants atteints d’AF
- Titre : Étude de Phase 1 visant à évaluer la sécurité, la tolérabilité, la pharmacocinétique et la pharmacodynamique du Nomlabofusp sous-cutané chez les adolescents et les enfants atteints d’ataxie de Friedreich.
- Intervention / traitement : Il s’agit d’une étude randomisée, en double aveugle, contrôlée par placebo, évaluant une dose de nomlabofusp basée sur le poids versus un placébo chez des adolescents et des enfants atteints d’AF. Les participants recevront une injection sous-cutanée de 0,8 mg/kg, avec une dose maximale de 50 mg, une fois par jour pendant 7 jours, ou placebo. L’étude comprendra au moins deux cohortes avec au moins 12 à 15 participants dans chaque cohorte.
- Phase : 1
- Age de participation à l’étude : 2 à 17 ans
- Nombre de participants : 30
- Date de début de l’étude : 06/12/2024 (dernière mise à jour : 21/02/2025)
- Site et contacts : United States, Chevy Chase, Maryland, 20815; Tamanna Roshan Lal, MB ChB, 541-232-7818, troshanlal@UncommonCures.com ou Kerri Gallagher, RN, B, 267-234-2167, kgallagher@UncommonCures.com
- Étude à doses multiples croissantes du DT-216P2 chez des patients atteints d’ataxie de Friedreich – Promoteur : Design Therapeutics
- Identifiant ClinicalTrials.gov : NCT06874010
- Notre compréhension du principe : Petites molécules, les “Gene-TAC” qui ciblent l’expansion GAA et, en construisant “un pont”, réactivent le gène de la frataxine.
- Objectif : Évaluer la sécurité, la tolérance et la pharmacocinétique du DT-216P2 administré à doses multiples croissantes chez des patients atteints d’AF.
- Titre : Étude ouverte de Phase 1/2 à doses multiples croissantes visant à évaluer la sécurité, la tolérance et la pharmacocinétique du DT-216P2 administré par voie sous-cutanée et intraveineuse chez des patients atteints d’ataxie de Friedreich.
- Intervention / traitement : Expérimental : le DT-216P2
- Phase : 1/2
- Age de participation à l’étude : 18 à 65 ans
- Nombre de participants : 20
- Date de début de l’étude : 06/2025 (dernière mise à jour : 18/05/2025)
- Site et contacts : Varlli Scott Phone Number: +613 8341 6228 Email: varlli.scott@mcri.edu.au Sydney, New South Wales, Australia, 2031. Scientia Clinical Research Ltd. East Melbourne, Victoria, Australia, 3002. Doherty Clinical Trials. Melbourne, Victoria, Australia, 3004. Nucleus Network
- Etude visant à déterminer comment le BIIB141 (Omaveloxolone) est métabolisé dans l’organisme et à en savoir plus sur son innocuité chez les participants âgés de 2 à 15 ans atteints d’ataxie de Friedreich (BOLD) – Promoteur : Biogen
- Identifiant ClinicalTrials.gov : NCT06054893
- Notre compréhension du principe : L’omaveloxone active la voie Nrf2, connue pour son rôle dans la réponse au stress oxydatif, et qui est réduite chez les patients atteints de l’ataxie de Friedreich. En France, la HAS a octroyé une autorisation d’accès précoce, après avis de l’ANSM concernant le bénéfice/risque présumé, pour SKYCLARYS® (omaveloxolone 50 mg, gélules) dans le traitement de l’ataxie de Friedreich (AF) chez les adultes et les adolescents âgés de 16 ans et plus.
- Objectif : Comprendre comment le BIIB141 est métabolisé dans l’organisme des enfants et des adolescents âgés de 2 à 15 ans.
Principales questions auxquelles les chercheurs souhaitent répondre dans cette étude :
- Comment le corps métabolise-t-il le BIIB141 chez les enfants et les adolescents ?
- Combien de participants présentent des problèmes médicaux pendant l’étude ?
- Y a-t-il des changements dans l’état de santé général des participants pendant l’étude ?
- Y a-t-il des changements dans la santé cardiaque des participants ?
- Y a-t-il des changements dans la façon dont les participants traversent la puberté ?
- Titre : Étude ouverte de Phase 1 visant à évaluer la pharmacocinétique, la sécurité, la tolérabilité, la pharmacodynamie et l’efficacité de l’omaveloxolone chez des enfants âgés de ≥2 à <16 ans atteints d’ataxie de Friedreich.
- Intervention / traitement : Omaveloxolone 150 mg ou dose ajustée en fonction d’analyses supplémentaires de sécurité et de pharmacocinétique bayésienne de population (popPK).
- Cohortes A1, A2 et A3 : participants âgés de 12 à <16 ans.
- Cohorte B1 : participants âgés de 7 à <12 ans et débutera en parallèle avec la cohorte A2
- Cohorte B2 : participants âgés de 7 à < 12 ans et débutera en parallèle avec la cohorte A3
- Cohorte C1 et C2 : participants âgés de 2 à <7 ans
- Phase : 1
- Age de participation à l’étude : 2 à 15 ans
- Nombre de participants : 35
- Date de début de l’étude : 01/07/2024 (dernière mise à jour : 07/10/2025)
- Site et contacts : US Biogen Clinical Trial Center or Global Biogen Clinical Trial Center Phone Number: 866-633-4636 Email: clinicaltrials@biogen.com David Lynch, MD, Children’s Hospital of Philadelphia, Philadelphia, Pennsylvania, United States, 19104 / Recruiting coordinator: 215-590-2242
- Étude visant à mieux comprendre les effets et la sécurité à long terme du BIIB141 (omaveloxolone) chez des participants âgés de 2 à 15 ans atteints de l’AF – Promoteur : Biogen
- Identifiant ClinicalTrials.gov : NCT06953583
- Notre compréhension du principe : L’omaveloxone active la voie Nrf2, connue pour son rôle dans la réponse au stress oxydatif, et qui est réduite chez les patients atteints de l’ataxia de Friedreich. En France, la HAS a octroyé une autorisation d’accès précoce, après avis de l’ANSM concernant le bénéfice/risque présumé, pour SKYCLARYS® (omaveloxolone 50 mg, gélules) dans le traitement de l’ataxie de Friedreich (AF) chez les adultes et les adolescents âgés de 16 ans et plus.
- Objectif : Comprendre comment le BIIB141 agit dans l’organisme et d’évaluer son innocuité chez les enfants et les adolescents âgés de 2 à 15 ans. Principales questions auxquelles les chercheurs souhaitent répondre dans cette étude : – Comment le BIIB141 affecte-t-il l’équilibre et la stabilité chez les participants AF? – Combien de participants présentent des problèmes médicaux pendant l’étude ? – Y a-t-il des changements dans l’état de santé général des participants pendant l’étude ? – Y a-t-il des changements dans la santé cardiaque des participants ? – Y a-t-il des changements dans la façon dont les participants traversent la puberté ?
- Titre : Étude de Phase 3 en deux parties, randomisée, en double aveugle, contrôlée par placebo (partie 1) et extension en ouvert (partie 2) visant à évaluer l’efficacité, la sécurité, la pharmacocinétique et la pharmacodynamique de l’omaveloxolone (BIIB141) chez des participants atteints d’ataxie de Friedreich âgés de 2 à < 16 ans.
- Intervention / traitement : La partie 1 de l’étude est contrôlée par placebo et la partie 2 est ouverte. – Expérimentale : Partie 1 essais contrôlé randomisé (ECR) : Omaveloxolone. Les participants recevront une dose orale unique d’omaveloxolone une fois par jour (QD) pendant une durée maximale de 52 semaines dans la Partie 1 de l’étude. Comparateur placebo : Partie 1 ECR : Placebo. Les participants recevront un placebo par voie orale, une fois par jour, pendant une durée maximale de 52 semaines dans la Partie 1 de l’étude. – Expérimentale : Partie 2 OLE : Omaveloxolone. Les participants qui terminent la Partie 1 de l’étude et qui sont éligibles recevront une dose orale unique d’omaveloxolone, une fois par jour, pendant une période pouvant aller jusqu’à 104 semaines dans la Partie 2 de l’étude OLE.
- Phase : 3
- Age de participation à l’étude : 2 à 15 ans
- Nombre de participants : 255
- Date de début de l’étude : 09/06/2025 (dernière mise à jour : 10/11/2025)
- Site et contacts : 28 Sites. En France (pas encore ouvert de recrutement): * Paris, 75012 AP-HP – Hôpital Armand Trousseau Principal Investigator : Florence Renaldo Contact : 01 85 34 00 29 Florence.renaldo@aphp.fr* Montpellier, Hérault, 34090 – CHU de Montpellier – Hôpital Arnaud de Villeneuve Principal Investigator : Agathe Roubertie Contact : 33 04 67 33 01 82 a-roubertie@chu-montpellier.fr
- Etude de phase IA et IB sur la thérapie génique AAVrh.10hFXN pour le traitement de la cardiomyopathie associée à l’ataxie de Friedreich – Promoteur : Weill Medical College of Cornell University
- Identifiant ClinicalTrials.gov : NCT05302271
- Notre compréhension du principe : AAVrh.10hFXN est un virus adéno-associé conçu pour porter le gène de la frataxine humaine aux cellules cardiaques.
- Objectif : Tester la sécurité et l’efficacité préliminaire de l’AAVrh.10hFXN dans le traitement de la cardiomyopathie associée à l’ataxie de Friedreich. L’AAVrh.10hFXN est administré par voie intraveineuse. Il s’agit d’une étude de Phase 1, ouverte, à doses croissantes.
- Titre : Étude de phase 1A et 1B de thérapie génique avec AAVrh.10hFXN pour la cardiomyopathie de l’ataxie de Friedreich.
- Intervention / traitement : AAVrh.10hFXN administré par voie intraveineuse et Prednisone (tous les participants suivront un traitement immunosuppresseur à base de prednisone pendant un total de 14 semaines).
- Phase : 1, ouverte, d’escalade de dose
- Age de participation à l’étude : 18 à 50 ans
- Nombre de participants : 25
- Début de l’étude : 22/02/2022 (dernière mise à jour : 16/05/2025)
- Site et contacts : United States, New York: Haley Bowe 646-962-2672 hab4007@med.cornell.edu ou Noor Hasan: 646-962-5583 noh4004@med.cornell.edu
Les essais non encore ouverts au recrutement
- Étude à dose unique croissante du DT-216P2 chez des participants sains normaux – Promoteur : Design Therapeutics
- Identifiant ClinicalTrials.gov : NCT06772870
- Notre compréhension du principe : Petites molécules, les “Gene-TAC” qui ciblent l’expansion GAA et, en construisant “un pont”, réactivent le gène de la frataxine.
- Objectif : Évaluer la sécurité, la tolérance et la pharmacocinétique de doses uniques croissantes de DT-216P2 administrées par voie sous-cutanée (SC) et intraveineuse (IV) à des participants sains. Environ 36 participants seront recrutés pour cette étude.
- Titre : Étude croisée de Phase 1, à double aveugle, randomisée, contrôlée par placebo, à dose unique croissante, visant à évaluer la sécurité, la tolérance et la pharmacocinétique du DT-216P2 administré par voie sous-cutanée et intraveineuse chez des participants sains normaux.
- Intervention / traitement : Expérimental : le DT-216P2 sera administré par injection sous-cutanée, perfusion sous-cutanée et perfusion intraveineuse. Comparateur placebo : une solution saline normale sera utilisée comme contrôle placebo.
- Phase : 1
- Age de participation à l’étude : 18 – 45 ans
- Nombre de participants : 36
- Date de début de l’étude : 02/2025 (dernière mise à jour : 21/02/2025)
- Site et contacts : Melbourne, Victoria, Australia, 3004 Nucleus Network, Level 5, 89 Commercial Road Contact : Ofer Gronen, MD +61 1300 715 787 o.gonen@nucleusnetwork.com.au
- Étude sur la thérapie génique SGT-212 dans l’AF (FALCON) – Promoteur : Solid Biosciences Inc.
- Identifiant ClinicalTrials.gov : NCT07180355
- Notre compréhension du principe : Thérapie génique médie par AAV (virus adéno-associé), conçu pour administrer la frataxine humaine par une double voie d’administration: une perfusion dans le noyau dentelé (à l’aide d’un dispositif guidé par IRM), suivie d’une perfusion intraveineuse afin d’augmenter les niveaux thérapeutiques de frataxine dans les noyaux dentelés du cervelet et dans les cardiomyocytes, respectivement.
- Objectif : Évaluer la sécurité et la tolérance du SGT-212 chez des participants atteints d’AF. Il s’agit d’une étude de phase 1b (la première chez l’homme), ouverte, visant à déterminer la dose optimale, qui évalue la sécurité et la tolérance du SGT-212. Il sera administré par double injection intra-dentelé (IDN) et intraveineuse (IV) à des participants atteints d’AF. Tous les participants recevront le SGT-212 et seront inclus dans l’étude pendant environ 5 ans.
- Titre : Essai clinique de phase 1b, en ouvert, visant à déterminer la dose optimale chez l’homme, afin d’évaluer la sécurité et la tolérance du SGT-212 administré par double voie intra-dentelé (IDN) et intraveineuse (IV) à des participants atteints d’ataxie de Friedreich.
- Intervention / traitement : Cohorte 1 : participants non ambulatoires Cohorte 2 : participants ambulatoires Cohorte 3 : participants ambulatoires et non ambulatoires (affinement ou augmentation de la dose) Tous les participant recevront une perfusion IDN bilatérale suivie d’une perfusion IV systémique de SGT-212, virus adéno-associé de sérotype AAVhu68 contenant un ADN complémentaire optimisé par codon (ADNc).
- Phase : 1b
- Age de participation à l’étude : 18 – 40 ans
- Nombre de participants : 10
- Date de début de l’étude : 22/10/2025 (dernière mise à jour : 20/10/2025)
- Site et contacts : Ohio Locations : Columbus, Ohio, United States, 43210 The Ohio State University Contact : Tyson Lacher / Tyson.Lacher@osumc.edu Principal Investigator : Yasushi Kisanuki, MD Pennsylvania Locations : Philadelphia, Pennsylvania, United States, 19104 The Children’s Hospital of Philadelphia (CHOP)
Documents associés

Avancer ensemble,
C’est aussi pouvoir compter sur votre aide !


